Schlüssel zur Verbesserung von Krebstherapien entdeckt
11.06.2024Manche Krebsmedikamente verursachen schwere Nebenwirkungen, weil sie nicht zielgerichtet genug arbeiten. Warum, das hat jetzt ein Team der Universität Würzburg rund um die Biochemikerin Caroline Kisker herausgefunden.
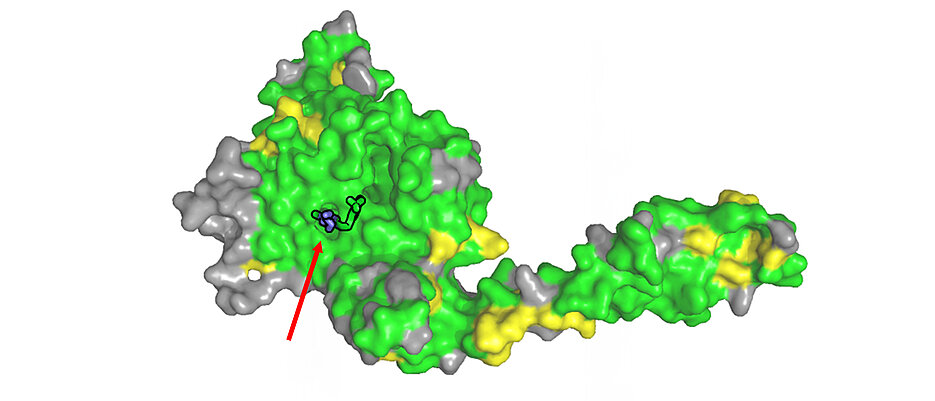
Kaum ein zellulärer Prozess in unserem Körper kommt ohne das kleine Protein Ubiquitin aus: Es orchestriert die Stabilität und Funktion der allermeisten Proteine. Wird es an andere Proteine angeheftet, sind diese oft für den Abbau freigegeben. Eine solche Markierung kann jedoch durch spezielle Enzyme auch wieder rückgängig gemacht werden. Das Enzym USP28 beispielsweise ist bekannt als Stabilisator von Proteinen, die entscheidend für Zellwachstum und -teilung sind – für das Wachstum von Krebs können diese ebenfalls eine wichtige Rolle spielen.
Um die Stabilität dieser Proteine zu verringern und so das Krebswachstum einzudämmen, wurden sogenannte Inhibitoren gegen USP28 entwickelt. Diese Hemmstoffe sind die Grundlage vieler, sich in Entwicklung befindlicher Krebsmedikamente und stören die Zellteilung, indem sie das Enzym USP28 blockieren. Das Problem: Häufig wirken sie nicht nur gegen USP28, sondern auch gegen USP25, ein eng verwandtes Enzym, das Ubiquitin von anderen Proteinen ablöst und als Schlüsselprotein des Immunsystems gilt. Die Weiterentwicklung von USP28-Inhibitoren zu in der Klinik anwendbaren Therapeutika ist deshalb wegen der absehbaren Nebenwirkungen sehr schwierig – sie reichen von Magen-Darm-Beschwerden bis hin zu Nervenschäden und sogar Autoimmunerkrankungen.
Verwechslungsgefahr zwischen beiden Enzymen
Wieso Inhibitoren nicht zielsicher ausschließlich USP28, sondern auch USP25 angehen, das haben Forschende der Julius-Maximilians-Universität Würzburg (JMU) jetzt herausgefunden: „Offenbar gibt es eine hohe Verwechslungsgefahr zwischen USP28 und USP25“, erklärt Caroline Kisker vom Lehrstuhl für Strukturbiologie am Würzburger Rudolf-Virchow-Zentrum und Vizepräsidentin für Forschung und wissenschaftlichen Nachwuchs. „Wir konnten zeigen, dass die beiden Enzyme in großen Bereichen, auch genau dort, wo die Inhibitoren wirken, sehr ähnlich oder sogar identisch sind.“
Im Rahmen ihrer Forschung untersuchte die Arbeitsgruppe der Biochemikerin mittels Röntgenkristallographie die Struktur von USP28 in Verbindung mit den drei Inhibitoren „AZ1“, „Vismodegib“ und „FT206“ – und ermittelte so die räumliche Bindestelle. Weitere biochemische Experimente an USP25 zeigten: Die Stellen, an denen die Inhibitoren bei USP28 und bei USP 25 andocken, sind identisch aufgebaut. „Die Hemmstoffe können also nicht unterscheiden, wo sie binden“ so Kisker. „Das erklärt die unspezifische Wirkung.“
Entdeckung ebnet Weg für die Entwicklung treffsicherer Inhibitoren
Die neue wissenschaftliche Erkenntnis liefert eine wichtige Grundlage für die Suche nach spezifischeren Medikamenten mit weniger Nebenwirkungen. Diese zu entwickeln, das ist das nächste große Ziel der Würzburger Forschenden. „Unsere strukturbiologischen Daten ermöglichen es uns, die bisherigen Inhibitoren so zu verändern, dass sie nur noch entweder gegen USP25 oder USP28 wirken“, sagt Kisker. „Zudem wollen wir nach Inhibitoren suchen, die bei den Enzymen an Stellen binden, die sich weniger ähnlich sind. Damit haben diese Moleküle eine höhere Zielgenauigkeit.“
Finanzielle Unterstützung für die Forschungsarbeit gab es von der Deutschen Forschungsgemeinschaft DFG.
Das Rudolf-Virchow-Zentrum in Würzburg
Das Rudolf-Virchow-Zentrum (RVZ) für Integrative und Translationale Bildgebung ist ein interdisziplinäres Forschungszentrum, das sich mit der Visualisierung elementarer Lebensprozesse beschäftigt – vom Subnano- bis zum Makromaßstab. Als zentrale Einrichtung der Universität Würzburg beherbergt das Zentrum derzeit 13 Forschungsgruppen mit translationalem Fokus und rund 100 Forschende, die die molekularen Ursachen von Gesundheit und Krankheit untersuchen.
Zur Studie
Structural basis for the bi-specifity of USP25 and USP28 inhibitors. Jonathan Vincent Patzke, Florian Sauer, Radhika Karal Nair, Erik Endres, Ewgenij Proschak, Victor Hernandez-Olmos, Christoph Sotriffer, Caroline Kisker. DOI: 10.1038/s44319-024-00167-w
Kontakt
Prof. Dr. Caroline Kisker, Lehrstuhl für Strukturbiologie am Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging sowie Vizepräsidentin für Forschung und wissenschaftlichen Nachwuchs, Tel. +49 931 31-80381, caroline.kisker@uni-wuerzburg.de







