Wie sich Herz und Hirn nach Infarkt effektiver schützen lassen
19.08.2024Ein neuer hochwirksamer Thrombosehemmer ist in Sicht: Würzburger Forschende präsentieren Hemmstoff zur effizienten Prävention und Behandlung arterieller Thrombosen und Entzündungsreaktionen ohne erhöhtes Blutungsrisiko.
Ein ungesunder Lebensstil, Krankheiten oder Verletzungen, genetische Veranlagung sowie eine erhöhte Blutgerinnungsneigung können die Bildung von Thromben in den Blutgefäßen begünstigen. Diese Gerinnsel behindern den Blutfluss zu lebenswichtigen Organen. Ein Infarkt droht. Die Vorbeugung und Behandlung von Thrombosen sind daher entscheidend, um schwerwiegende Komplikationen zu vermeiden.
Professor Bernhard Nieswandt, Forschungsgruppenleiter am Rudolf-Virchow-Zentrum (RVZ) der Julius-Maximilians-Universität Würzburg (JMU) und Leiter des Lehrstuhls für Experimentelle Biomedizin I am Universitätsklinikum Würzburg (UKW), veröffentlichte jetzt mit seinem Team im European Heart Journal eine Studie zu einem neuen, hochwirksamen und gleichzeitig sehr nebenwirkungsarmen antithrombotischen Wirkstoff, der breite therapeutische Anwendung finden könnte.
Oberflächenrezeptor spielt Schlüsselrolle beim Verklumpen von Blutplättchen
Bernhard Nieswandt beschäftigt sich seit Beginn seiner wissenschaftlichen Laufbahn mit Thrombozyten, auch bekannt als Blutplättchen, und hat auf diesem Gebiet Pionierarbeit geleistet. Vor 25 Jahren beschrieb er erstmalig die Funktion des Rezeptors Glykoprotein VI, kurz GPVI, der ausschließlich in Thrombozyten und ihren Vorläuferzellen im Knochenmark zu finden ist.
Dieser Oberflächenrezeptor ist vor allem für die Bindung von Kollagen an der verletzten Gefäßwand verantwortlich, was die Aktivierung und das Verklumpen der Blutplättchen auslöst. So können die kleinen kernlosen Zellen, die nur einen Tausendstel Millimeter groß sind und von denen wir etwa 250 Millionen in jedem Milliliter Blut haben, ihre zentrale Rolle bei der Hämostase erfüllen, und die Blutungen nach Verletzungen stillen.
Eine übermäßige Aktivierung des Rezeptors GPVI kann jedoch zur Bildung krankhafter Thromben und damit zu Gefäßverschlüssen sowie akut bedrohlichen Ereignissen wie Herzinfarkt oder Schlaganfall führen. Darüber hinaus sind Thrombozyten maßgeblich an Entzündungsreaktionen beteiligt, und auch hier ist GPVI von zentraler Bedeutung.
Mechanismus zur Hemmung des Rezeptors entdeckt
„Die Würzburger Forschungsarbeiten der vergangenen 25 Jahre zeigten eindrücklich, dass GPVI eine vielversprechende Zielstruktur für anti-thrombotische und anti-entzündliche Therapien ist, und legten damit das Fundament für die Entwicklung und klinische Erprobung von GPVI-Inhibitoren“, erklärt Bernhard Nieswandt. Der Biologe entdeckte einen Mechanismus, mit dem GPVI sowohl gehemmt als auch ausgeschaltet werden kann.
Ein erstes Medikament, der GPVI-Hemmer ACT017/Glenzocimab, wurde inzwischen von einer französischen Forschungsgruppe – basierend auf der Grundlagenforschung der Würzburger Universitätsmedizin – in die klinische Phase III gebracht: „Erste klinische Daten mit diesem GPVI-Hemmer bei Schlaganfallpatientinnen und -patienten wurden kürzlich veröffentlicht, waren sehr vielversprechend und deuten darauf hin, dass dieser therapeutische Ansatz im Menschen funktionieren kann“, sagt Bernhard Nieswandt.
Auch sein Team hat einen GPVI-blockierenden Antikörper entwickelt, der in seiner Wirksamkeit die bisherigen Wirkstoffe weit übertrifft, sogar bei sehr niedrigen Dosen, und dabei gleichzeitig das Blutungsrisiko nicht erhöht. „Unser Antikörper ist um den Faktor 50 potenter als die bislang beschriebenen GPVI-Inhibitoren und dürfte daher eine höhere klinische Wirksamkeit und breitere Einsatzmöglichkeiten haben“, meint Bernhard Nieswandt.
Late-Breakthrough-Abstract auf Kongress in Bangkok
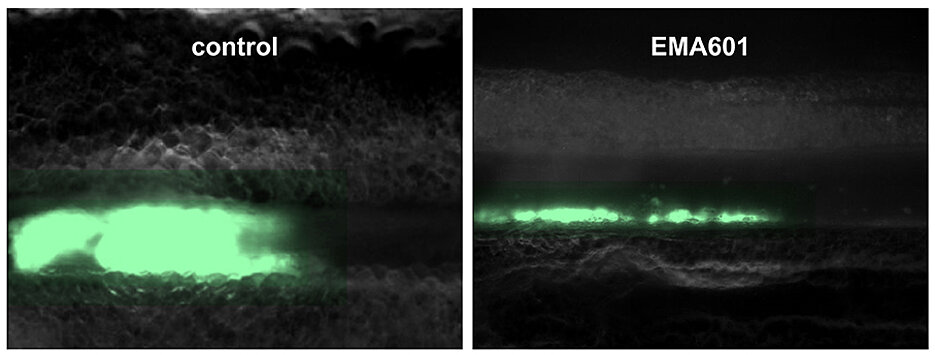
Entwickelt wurde der GPVI-Inhibitor EMA601 von der unterfränkischen Biotech-Firma EMFRET Analytics, die Bernhard Nieswandt einst mitbegründete. Funktionell untersucht wurde der Hemmstoff von Forschenden des UKW, des RVZ und der JMU, allen voran von Dr. Stefano Navarro. Er analysierte im Rahmen seiner Doktorarbeit sowohl Antikörperfragmente von Mäusen als auch humanisierte Antikörper in vitro und in vivo und ist Erstautor der Publikation. Seine Ergebnisse stellte der Wissenschaftler bereits als Late-Breakthrough-Presentation auf dem Congress of the International Society on Thrombosis and Haemostasis im Juni 2024 in Bangkok vor.
Stefano Navarros Fazit: „EMA601 ist ein konzeptionell neuartiger und vielversprechender Wirkstoff zur Behandlung und Sekundärprophylaxe von Blutgerinnseln, um Infarkte zu verhindern, aber auch zur Unterdrückung von Entzündungsprozessen, die durch Blutplättchen verursacht werden und lebenswichtige Organe schädigen können.“
Neuer Wirkstoff scheint Blutgerinnung nicht zu beeinträchtigen
Bernhard Nieswandt erklärt die klinischen Hintergründe: „Sekundärprophylaxe bedeutet am Beispiel eines Schlaganfalls, dass nach erfolgreicher Entfernung des Embolus, der ins Hirn gewandert ist und die Blutversorgung unterbrochen hat, noch die Quelle des Embolus antithrombotisch behandelt werden muss. Doch selbst wenn der Blutfluss nach einem Infarkt in Herz oder Hirn wiederhergestellt wurde, können die Blutplättchen als Modulatoren des Immunsystems immer noch Entzündungen vorantreiben und Gewebeschädigungen begünstigen.“ Für diese Entzündungsprozesse wurde in Würzburg der Begriff Thrombo-Inflammation geprägt.
Ein weiterer wesentlicher Vorteil des Antikörpers EMA601 ist, dass er die normale Blutgerinnung nicht zu beeinträchtigen scheint, während herkömmliche antithrombotische Wirkstoffe, die derzeit klinisch eingesetzt werden, mit einer erhöhten Blutungsneigung einhergehen.
Bernhard Nieswandt: „In der Neurologie sehen unsere Kolleginnen und Kollegen immer noch eine beträchtliche Anzahl von Patientinnen und Patienten, deren Herzinfarkt kardiologisch gut behandelt wurde, bei denen aber plötzlich eine Hirnblutung auftritt. Auch für diese klinische Situation könnte der GPVI-Hemmer ein großer Fortschritt sein.“
Publikation
Stefano Navarro, Ivan Talucci, Vanessa Göb, Stefanie Hartmann, Sarah Beck, Valerie Orth, Guido Stoll, Hans M Maric, David Stegner, Bernhard Nieswandt, The humanized platelet glycoprotein VI Fab inhibitor EMA601 protects from arterial thrombosis and ischaemic stroke in mice, European Heart Journal, 2024; ehae482, https://doi.org/10.1093/eurheartj/ehae482







