Steuerungsmolekül in Blutplättchen identifiziert
06.08.2020Das Molekül BIN2 ist zentral bei der Aktivierung der Blutplättchen, wie ein Würzburger Forschungsteam nun zeigen konnte. Dies könnte bei der Medikamentenentwicklung gegen Thrombosen, Herzinfarkte oder Schlaganfälle helfen.
Kalzium ist in fast allen Zellen ein wichtiges Signalmolekül. Auch Blutplättchen, in der Fachsprache Thrombozyten genannt, werden durch Kalzium aktiviert und tragen dann zur Blutstillung und zum Wundverschluss bei. Allerdings kann eine fehlgeleitete Aktivierung der Blutplättchen durch unkontrollierte Kalzium-Signale auch zu akut lebensbedrohlichen Ereignissen wie Thrombosen, Herzinfarkten und Schlaganfällen führen, sowie Entzündungsreaktionen in den Blutgefäßen auslösen.
Mitspieler der Thrombozyten-Aktivierung identifiziert
Bisher war vor allem das Molekül stromal interaction molecule 1 (STIM1) als essentieller Baustein bei der Regelung von Kalziumsignalen bekannt. Allerdings hat es diese Funktion in fast allen Zellen des Körpers inne und ein Verlust von STIM1 hat daher starke Auswirkungen wie die Schwächung des Immunsystems. Aus diesem Grund eignet es sich nicht als Zielstruktur für die Entwicklung von Medikamenten.
„In unserer Studie konnten wir das bisher recht unbekannte Molekül BIN2 (bridging integrator 2) als neuen Interaktionspartner von STIM1 in Blutplättchen identifizieren und darüber hinaus zeigen, dass BIN2 auch mit einem weiteren Baustein der Kalzium-Maschinerie interagiert“, erklärt Prof. Dr. Bernhard Nieswandt vom Rudolf-Virchow-Zentrum der Universität Würzburg. Das Besondere an BIN2 ist, dass es sehr spezifisch in Blutplättchen vorkommt und nicht, wie STIM1, in vielen anderen Zellen. „Dadurch können wir die Thrombozyten zielgenau ansteuern, ohne die Funktionen in anderen Zellen zu stören“, ergänzt Doktorandin Julia Volz, die entscheidend an der Studie mitwirkte. Veröffentlicht wurde die Studie im Journal of Clinical Investigation.
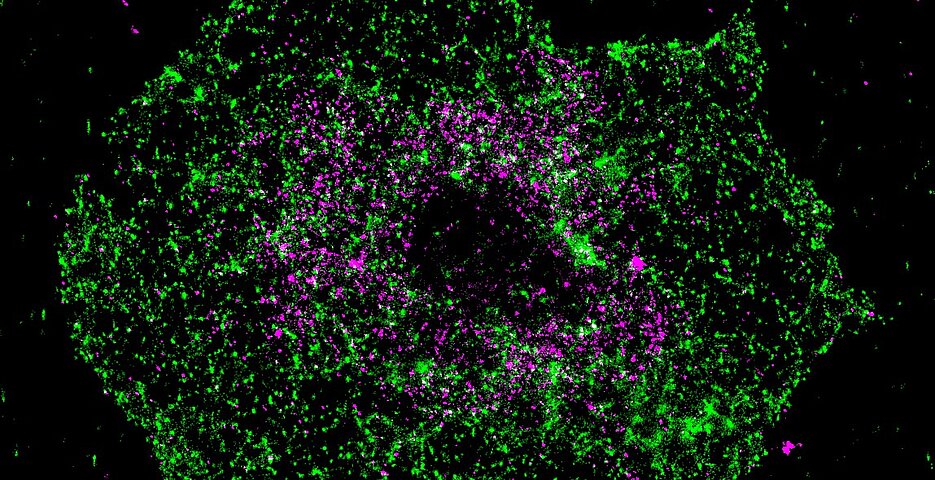
Die Entdeckung wurde durch die Zusammenarbeit mehrerer Forschungsgruppen aus dem Sonderforschungsbereich Transregio 240, der Universität Würzburg und des Uniklinikums Würzburg und deren breites Methodenspektrum möglich. „Durch Superhochauflösende Fluoreszenzmikroskopie konnten wir nachweisen, dass die Moleküle STIM1 und BIN2 im Plättchen in gewissen Abständen kolokalisieren und damit die biochemischen Daten untermauern“, erklärt Charly Kusch, der ebenfalls als Doktorand maßgeblich an der Arbeit beteiligt war.
Mäuse ohne BIN2 sind vor schweren Verläufen des Schlaganfalls geschützt
Mäuse die kein BIN2 haben weisen stark reduzierte Kalziumsignale in den Thrombozyten auf. Dadurch kommt es in ihren Blutgefäßen nach Beschädigung der Gefäßwand zu kleineren Blutgerinnseln, die Tiere sind teilweise geschützt vor arterieller Thrombose und Schlaganfälle haben einen milderen Verlauf. Das zeigt, dass Moleküle wie BIN2 ein Ansatzpunkt für die Medikamentenentwicklung gegen Thrombosen, Herzinfarkte und Schlaganfälle sein könnten. Dazu müssen nun die genauen molekularen Mechanismen und weitere Interaktionspartner untersucht werden.
Forschungsförderung und Personen
Die Forschung wurde gefördert durch die Deutsche Forschungsgemeinschaft, die Europäische Union (Thrombo-Inflame, EFRE – Europäischer Fonds für regionale Entwicklung, Bavaria), die German Excellence Initiative to the Graduate School of Life Sciences, University of Würzburg, das Ministerium für Kultur und Wissenschaft des Landes Nordrhein-Westfalen und das Bundesministerium für Bildung und Forschung.
Prof. Dr. Bernhard Nieswandt ist Inhaber des Lehrstuhls für Experimentelle Biomedizin mit Schwerpunkt Vaskuläre Biologie und Leiter des Instituts für Experimentelle Biomedizin, das vom Uniklinikum Würzburg (UKW) und dem Rudolf-Virchow-Zentrum der Julius-Maximilians-Universität Würzburg gemeinsam getragen wird. Er ist Sprecher des Sonderforschungsbereichs/Transregio 240, der seit 2018 von der Deutschen Forschungsgemeinschaft gefördert wird. Julia Volz forschte bis Mai 2020 in der Arbeitsgruppe Nieswandt am Rudolf-Virchow-Zentrum der Universität Würzburg. Charly Kusch forscht in der Arbeitsgruppe Nieswandt am Rudolf-Virchow-Zentrum der Universität Würzburg.
Über das Rudolf-Virchow-Zentrum
Das Rudolf-Virchow-Zentrum gehört als zentrale Einrichtung zur Universität Würzburg. Die Forschungsgruppen arbeiten auf dem Gebiet der Schlüsselproteine, die für die Funktion von Zellen und damit für Gesundheit und Krankheit besonders wichtig sind.
Publikation
Julia Volz, Charly Kusch, Sarah Beck, Michael Popp, Timo Vögtle, Mara Meub, Inga Scheller, Hannah S. Heil, Julia Preu, Michael K. Schuhmann, Katherina Hemmen, Thomas Premsler, Albert Sickmann, Katrin G. Heinze, David Stegner, Guido Stoll, Attila Braun, Markus Sauer, Bernhard Nieswandt: BIN2 orchestrates platelet calcium signaling in thrombosis and thrombo-inflammation, The Journal of Clinical Investigation
Kontakt
Prof. Dr. Bernhard Nieswandt, Rudolf-Virchow-Zentrum und Lehrstuhl für Experimentelle Biomedizin, Universitätsklinikum Würzburg, T +49 931 - 31 80406, bernhard.nieswandt@uni-wuerzburg.de







