Wie Zellen Schäden am Erbgut erkennen und reparieren
04.10.2024Schäden am Erbgut sind die Ursache zahlreicher Krankheiten. Dabei verfügen Zellen über wirksame Reparaturmechanismen. Ein Forschungsteam der Universität Würzburg hat jetzt neue Einblicke in die DNA-Schadensantwort gewonnen.
Wann immer Zellen sich teilen, ist die Gefahr von Schäden am Erbgut groß. Immerhin muss die Zelle vor der Teilung ihr gesamtes Erbgut verdoppeln und dafür Milliarden genetischer Buchstaben kopieren. Dabei kommt es immer wieder zu „Lesefehlern“. Aber auch andere Faktoren sind dafür verantwortlich, dass sich bei jedem Menschen im Laufe des Lebens Schäden im Erbgut anhäufen: Sonne, Alkohol, Zigaretten sind nur ein paar Beispiele für Faktoren, von denen bekannt ist, dass sie das Erbgut schädigen und damit unter anderem Krebs auslösen können.
Natürlich steht die Zelle solchen Defekten nicht machtlos gegenüber. Sie verfügt über einen umfangreichen Katalog an zellulären Mechanismen, die nach einem DNA-Schaden in Gang gesetzt werden. DNA Damage Response, kurz DDR, lautet der Fachbegriff dafür – auf Deutsch DNA-Schadensantwort. Spezifische Signalwege leiten in der Regel die sofortige Erkennung und Reparatur des Schadens ein und sichern so das Überleben der Zelle.
Ein neuer Blick auf die DNA-Schadensantwort
Einen dieser Signalwege hat sich jetzt ein Team von Wissenschaftlerinnen und Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU) genauer angesehen. Dabei hat die Gruppe einen neuen Mechanismus der DNA-Schadensantwort identifiziert, der über ein RNA-Transkript vermittelt wird. Ihre Ergebnisse tragen dazu bei, den Blick auf die DNA-Schadensantwort konzeptionell zu weiten und enger mit dem RNA-Stoffwechsel zu verzahnen.
Verantwortlich für diese Studie war Dr. Kaspar Burger, Nachwuchsgruppenleiter am Lehrstuhl für Biochemie und Molekularbiologie. Die Gruppe hat die Ergebnisse ihrer Untersuchungen in der Fachzeitschrift Genes & Development veröffentlicht.
RNA-Transkripte als Regulatoren der Genomstabilität
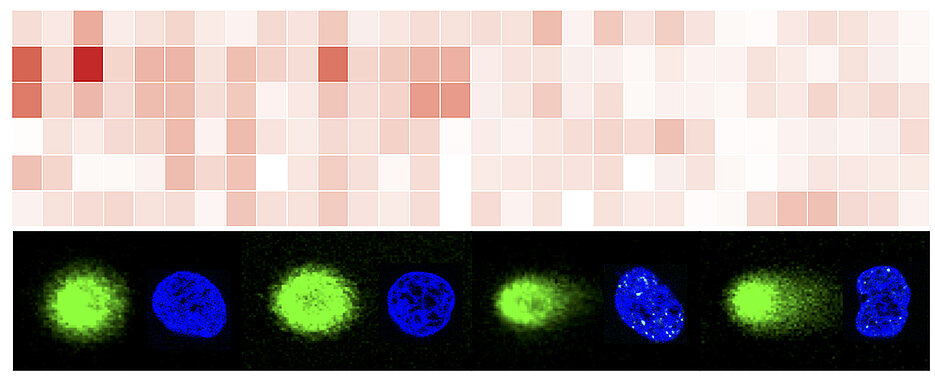
„Wir haben uns in unserer Studie auf sogenannte lange nicht-kodierende RNA-Transkripte konzentriert. Vorherige Forschungsergebnisse sprechen dafür, dass einige dieser Transkripte als Regulatoren der Genomstabilität fungieren“, erklärt Kaspar Burger den Hintergrund der Arbeit. Im Fokus der Studie stand das im Zellkern angereicherte abundante Transkript 1 – auch NEAT1 genannt. In vielen Tumorzellen ist NEAT1 in hoher Konzentration anzutreffen; bekannt ist auch, dass es auf Schäden am DNA-Strang und auf zellulären Stress reagiert. Seine genaue Rolle bei der DNA-Schadensantwort war bislang jedoch unklar.
„Unsere Hypothese war, dass der RNA-Stoffwechsel NEAT1 in die DNA-Schadensantwort einbindet, um auf diese Weise die Stabilität des Genoms zu gewährleisten“, sagt Burger. Zur Überprüfung dieser These hat die Forschungsgruppe experimentell untersucht, wie NEAT1 auf gravierende Schäden am Erbgut – sogenannte DNA-Doppelstrangbrüche – in Knochenkrebszellen des Menschen reagiert. Das Ergebnis: „Wir konnten zeigen, dass die eingebrachten DNA-Schäden sowohl die Zahl der NEAT1-Transkripte als auch die Menge der N6-Methyladenosin-Markierungen auf NEAT1 erhöhen“, so der Wissenschaftler.
In Krebszellen sind Marker häufig falsch platziert
Methyladenosin-Markierungen auf RNA-Transkripten sind ein Thema, mit dem sich die Wissenschaft noch nicht allzu lange beschäftigt. Sie fallen in den Bereich der Epitranskriptomik – den Fachbereich in der Biologie, der sich mit der Frage beschäftigt, wie RNA-Modifikationen an der Regulation der Genexpression beteiligt sind. Methylgruppen spielen dabei eine wesentliche Rolle. So ist beispielsweise bekannt, dass in Krebszellen RNA-Modifikationen häufig falsch platziert sind.
NEAT1 setzt DNA-Reparaturfaktor frei
So zeigen die Experimente von Kaspar Burger und seinem Team, dass das gehäufte Auftreten von DNA-Doppelstrangbrüchen die übermäßige Methylierung von NEAT1 hervorruft, was Veränderungen in der NEAT1-Sekundärstruktur nach sich zieht. In der Folge sammelt sich stark methyliertes NEAT1 an diesen Bruchstellen an und treibt die Erkennung gebrochener DNA voran. Im Gegenzug verzögerte eine experimentell herbeigeführte Unterdrückung der NEAT1-Expression die DNA-Schadensantwort, was erhöhte DNA-Schadensmengen zur Folge hatte.
NEAT1 selbst repariert die Schäden am Erbgut nicht. Wie das Würzburger Team herausfand, ermöglicht es jedoch die kontrollierte Freisetzung und Aktivierung eines RNA-bindenden DNA-Reparaturfaktors. Auf diesem Weg kann die Zelle DNA-Schäden hoch effizient erkennen und reparieren.
Das Wissen über die Rolle der NEAT1-Methylierung bei der Reparatur von Schäden am Erbgut könnte nach Ansicht der Wissenschaftlerinnen und Wissenschaftler neue therapeutische Optionen bei Tumoren mit hoher NEAT1-Expression ermöglichen. Zuvor müsse allerdings noch geklärt werden, ob diese Ergebnisse, die an einfachen Zellsystemen gewonnen wurden, auch auf komplexe Tumormodelle übertragbar sind.
Unterstützt wurde Kaspar Burgers Forschung von der Deutschen Krebshilfe und dem Mildred-Scheel-Nachwuchszentrum (MSNZ) Würzburg.
Originalpublikation
NEAT1 promotes genome stability via m6A methylation-dependent regulation of CHD4. Victoria Mamontova, Barbara Trifault, Anne-Sophie Gribling-Burrer, Patrick Bohn, Lea Boten, Pit Preckwinkel, Peter Gallant, Daniel Solvie, Carsten P. Ade, Dimitrios Papadopoulos, Martin Eilers, Tony Gutschner, Redmond P. Smyth, Kaspar Burger. Genes & Development
http://www.genesdev.org/cgi/doi/10.1101/gad.351913.124
Kontakt
Dr. Kaspar Burger, Lehrstuhl für Biochemie und Molekularbiologie, T: +49 931 31-48975, kaspar.burger@uni-wuerzburg.de







