Krebsforschung: DNA-Reparatur-Mechanismus weiter entschlüsselt
05/31/2024Forschende der Uni Würzburg rund um die Chemikerinnen Caroline Kisker und Claudia Höbartner haben aufgedeckt, wie das Protein XPD schwerwiegende DNA-Schäden erkennt und deren Reparatur steuert.
Forschende der Uni Würzburg rund um die Chemikerinnen Caroline Kisker und Claudia Höbartner haben aufgedeckt, wie das Protein XPD schwerwiegende DNA-Schäden erkennt und deren Reparatur steuert.
Das XPD-Protein ist ein zentraler Baustein unseres körpereigenen „DNA-Reparaturteams“, der sogenannten Nukleotid-Exzisions-Reparatur (NER). Wie ein Suchhund legt die NER markierte Schadstellen frei, spürt beschädigte DNA auf und rekrutiert andere Reparaturproteine, um die defekten Abschnitte auszuschneiden und zu ersetzen. Bei gesunden Menschen verhindert XPD zum Beispiel die Entstehung von Hautkrebs, indem es durch UV-Strahlung geschädigte DNA erkennt und repariert.
Wie genau es dem XPD-Protein gelingt, DNA-Schäden freizulegen und zu identifizieren, das hat nun erstmals ein Forschungsteam der Julius-Maximilians-Universität Würzburg (JMU) herausgefunden. Geleitet wurde es von der Biochemikerin Caroline Kisker, Inhaberin des Lehrstuhls für Strukturbiologie am Würzburger Rudolf-Virchow-Zentrum, in Zusammenarbeit mit der Chemikerin Claudia Höbartner vom Lehrstuhl für Organische Chemie I.
Studie zu schwerer DNA-Schädigung
Im Fokus des Würzburger Teams stand die Frage, wie das XPD-Protein bei der sogenannten Interstrangvernetzung arbeitet – es ist eine der schwersten bekannten DNA-Schädigungen. Verursacht wird sie etwa durch Umweltgifte und Industriechemikalien. „Interstrangvernetzungen sorgen dafür, dass DNA bei der Zellteilung nicht korrekt kopiert und abgelesen wird“, erklärt Caroline Kisker. „Das führt zu Erbgutschäden, die zur Entstehung von Krebs führen können.“
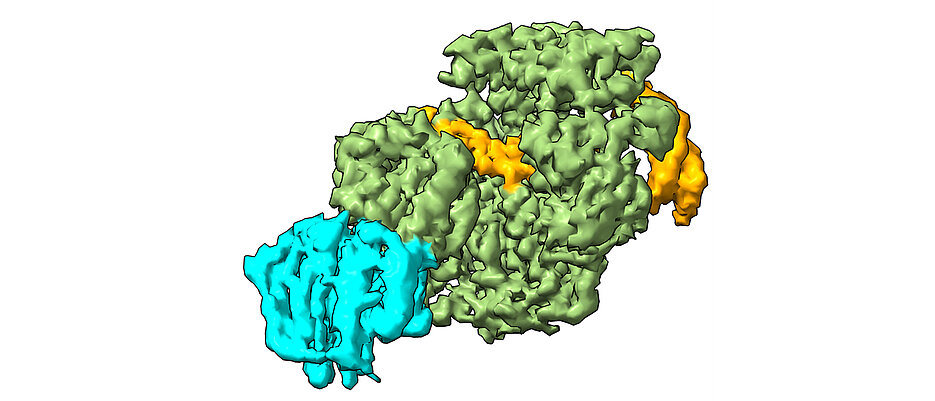
Bei ihrer Studie analysierten die Wissenschaftlerinnen mithilfe von Kryo-Elektronenmikroskopie, wie XPD die Doppelhelix der DNA entwindet, um die Fehlstellen einer Interstrangvernetzung offenzulegen und generierten ein Modell, wie der Schaden erkannt und herausgeschnitten wird. „Die Erkenntnisse aus unserer Arbeit schaffen die Grundlage für neue Ansätze zur Behandlung verschiedener Krebsarten“, sagt Jochen Kuper, Mitarbeiter in Kiskers Team. „Indem wir Reparatur-Mechanismen wie NER bei Krebszellen gezielt schwächen, könnten wir die Wirksamkeit von Medikamenten deutlich erhöhen.“
In weiteren Untersuchungen will das Forschungsteam nun untersuchen, wie XPD verschiedene weitere DNA-Schäden erkennt. Finanziell unterstützt wurde die Forschung von der Deutschen Forschungsgemeinschaft (DFG) und der deutschen Krebshilfe.
Das Rudolf-Virchow-Zentrum in Würzburg
Das Rudolf-Virchow-Zentrum (RVZ) für Integrative und Translationale Bildgebung ist ein interdisziplinäres Forschungszentrum, das sich mit der Visualisierung elementarer Lebensprozesse beschäftigt – vom Subnano- bis zum Makromaßstab. Einen Forschungsschwerpunkt bildet die Erforschung der Nukleinsäuren DNA und RNA. Als zentrale Einrichtung der Universität Würzburg beherbergt das Zentrum derzeit 13 Forschungsgruppen mit translationalem Fokus und rund 100 Forschende, die die molekularen Ursachen von Gesundheit und Krankheit untersuchen.
Zur Studie
Jochen Kuper, Tamsanqa Hove, Sarah Maidl, Hermann Neitz, Florian Sauer, Maximilian Kempf, Till Schroeder, Elke Greiter, Claudia Höbartner & Caroline Kisker. „XPD stalled on crosslinked DNA provides insight into damage verification“. Nature Structural and Molecular Biology. DOI: 10.1038/s41594-024-01323-5 [Link: https://www.nature.com/articles/s41594-024-01323-5]
Kontakt
Prof. Dr. Caroline Kisker, Lehrstuhl für Strukturbiologie am Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging sowie Vizepräsidentin für Forschung und wissenschaftlichen Nachwuchs, Tel. +49 931 31-80381, caroline.kisker@uni-wuerzburg.de
Prof. Dr. Claudia Höbartner, Lehrstuhl für Organische Chemie I, Tel. +49 931 31-89693, claudia.hoebartner@uni-wuerzburg.de